摘要:近在SARS-CoV-2临床试验中mRNA疫苗的成功应用一部分归功于纳米颗粒脂质体递送系统的开发,该系统不*在肌肉注射后有效表达mRNA编码的免疫原,而且作为佐剂和疫苗反应发挥作用。我们概述了mRNA递送系统,并重点介绍了目前SARS-CoV-2疫苗临床试验中使用的纳米颗粒脂质体。这篇综述文末分析了基因疫苗中纳米颗粒脂质体性能的决定因素。
简介
由于COVID-19在全球的大流行,mRNA疫苗被推到了生物技术和制药工业的中心舞台。由BioNTech/辉瑞、Moderna、CureVac、Sanofi/TranslateBio、Arcturus/Duke-NUS新加坡医学院、伦敦帝国理工学院、泰国朱拉隆功大学和Providence Therapeutics领导的mRNA疫苗人体试验共有8个正在进行。
值得注意的是,其中两项试验已经公布了3期临床中期结果,报告了接种2次30 µg或100 µg剂量LNP包裹的编码刺突蛋白免疫原的mRNA序列后,病毒感ran率降低94%以上。疫苗开发的速度也远超出了预期,在SARS-CoV-2序列*公开后10个月就有了如此**的效果。这一成功不*证明了生物技术和制药业有应对紧急和紧缺的全球性需求的能力,也证明了mRNA作为一种药物的所具有的能力,在中mRNA作为一种预防性疫苗。本综述的目的是概述mRNA递送系统的发展、总结SARS-CoV-2 mRNA疫苗的临床前和临床发现,并将其与其成功的递送系统特征联系起来。近有几篇早于爆发的关于疫苗和zhi疗mRNA递送系统的的优综述已经发表。
与小分子、DNA、寡核苷酸、病毒系统和蛋白质,包括抗体等的其他药物形式相比,mRNA疗法具有许多优势和几个难点。与寡核苷酸和大多数小分子药物有限的靶点相比,mRNA可以调节刺激和抑制作用方式,也能够表达或替换缺陷蛋白,这扩大了其使用的潜在适应症范围。
与DNA相比,mRNA只需要获得细胞质的核糖体翻译机制而不用进入细胞核,因此没有整合到人体基因组的风险。与蛋白质和病毒系统相比,mRNA的制造是在细胞外快速制备的,并且蛋白质产物具有天然的糖基化和构象性质。当与脂质纳米颗粒(LNP)递送系统结合时,mRNA LNP的纳米结构特性也与病毒系统和循环的内源性含脂质乳糜微粒的大小、脂质包膜和内部基因组物质等方面具有相似性,并且有助于其作为疫苗和其他zhi疗药物的递送载体材料。
mRNA的难点在于其先天的免疫原性,对酶降解的敏感性以及细胞对裸露的mRNA摄取几乎可以忽略不计。mRNA的先天免疫原性是由于toll样受体(TLRs)、解旋酶受体(包括视黄酸诱导基因I (RIG-I)样受体(RLRs)等)对单链和双链RNA的识别,然后这些受体通过NF-κB和干扰素(IFN)调节因子IRF3和IRF7发出信号并转位到细胞核,与I型IFN基因启动子结合,诱导I型IFN(IFN-α和IFN-β)的表达,并伴有促炎细胞因子产生,如**坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-12(IL-12)。分泌的干扰素作为一种病毒防御机制,通过其受体和同一细胞及相邻细胞中的JAK/STAT途径发出信号,**300多个受干扰素刺激的基因,包括蛋白激酶PKR。
虽然这种**可能有利于对mRNA疫苗产生免疫反应,但直接作用是通过eIF2a的PKR磷酸化来下调翻译,这样损害了eIF2的活性,抑制了mRNA翻译,从而抑制了免疫原的蛋白质合成。消除这种先天免疫反应的主要方法是将天然存在的核苷如1-甲基二脲苷和核糖体RNA(通常不在mRNA中)中存在的其他核苷替换到mRNA序列中,这使得它不能被先天免疫传感器检测到。这种核苷修饰的免疫应答mRNA是mRNA技术的基础,该技术近在BioNTech/辉瑞和Moderna疫苗试验中显示了超过94%的有效性,这些技术是建立在对其他病原体试验的基础上,下文将详细描述。
由于TLR7和TLR8主要识别富含GU的单链RNA序列,CureVac采用了第二种方法包括密码子优化和尽量不使用鸟苷酸。mRNAzhi疗的第二个难点是其对核酸酶的敏感性,例如在它血清中的半衰期< 5分钟。尽管siRNA的化学修饰在提高稳定性和降低免疫原性方面非常成功,但迄今为止,由于翻译机制对化学修饰的敏感性,使得它们在mRNA修饰并不成功。mRNA的第三个难点是大多数细胞类型(除不成熟的树突细胞外)缺乏对裸露的mRNA的细胞摄取吸收。
后两个难点可以通过将核苷修饰或mRNA导入适宜递送系统来解决,这样既保护mRNA免受核酸酶的攻击,又促进细胞摄取。比如,当在动物模型中给药时,与裸露的mRNA相比,加入纳米颗粒脂质体可保护mRNA免受核酸酶的攻击,并增强细胞摄取和表达高达1000倍。
质粒DNA主链通过体外转录(IVT)产生zhi疗性mRNA,其带有5’端的帽子结构、5’端的非翻译区(UTR)、编码目的蛋白开放阅读框、3’端UTR和polyA尾。天然真核生物的5’端帽子(cap0)是一种倒置的7-甲基鸟苷(m7G),通过5’-5’三磷酸盐与mRNA的**个核苷酸相连。
Cap0保护内源性mRNA免受核酸酶攻击,参与核输出,与翻译起始因子4结合,启动蛋白质翻译。另外两个5’端帽子结构被证实(帽子1和帽子2)在第二个或第三个核糖核苷酸上含有额外的甲基,其免疫原性低于cap0(因此更佳)。目前常用的加帽方法包括共转录加帽,产生具有高翻译和低免疫原性的帽子1。5’端UTR参与翻译起始,包含一个Kozak序列以及一个非帽依赖翻译的核糖体进入位点。开放阅读框之后是3’端UTR,它影响mRNA的稳定性和蛋白质表达的持久性。polyA尾在大约100个残基上编码,有助于启动翻译和延缓降解。体外转录(IVT)生产的mRNA需要经过纯化,以去除具有免疫原性的DNA和双链RNA污染物。
上述的mRNA可以是核苷修饰的,也可以是未经核苷修饰的序列,但不能进行自我复制。能够复制的自扩增mRNA (samRNA)也正在进行临床试验测试,其长度约为10 kb,由于它们有四个额外编码的非结构基因,包括一个RNA依赖的RNA聚合酶,导致了细胞内的自复制,但由于缺乏结构基因,不会产生感ran性粒子。
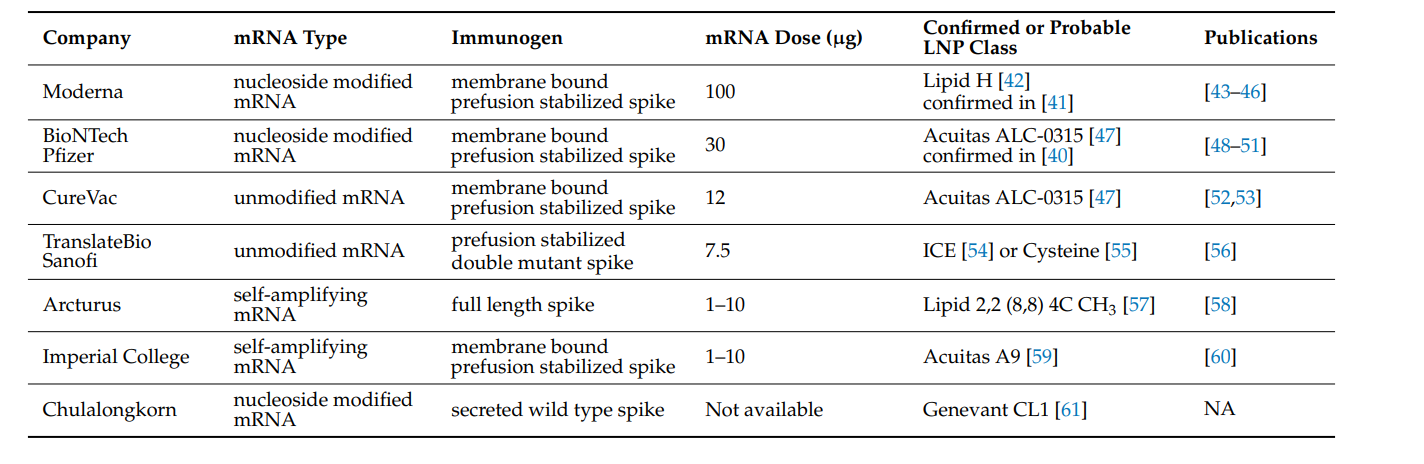
samRNA不能被核苷修饰,因为这些修饰会干扰自身扩增。在目前的临床试验中,由于samRNA的扩增过程,其通常使用较低的剂量(1-10 µg),而非扩增的mRNA则需使用30-100 µg。表1总结了目前所有上述类别在进行人体临床测试的mRNA疫苗。这些临床试验中的所有mRNA递送系统都是纳米颗粒脂质体。
BioNTech/辉瑞LNP和Moderna LNP已经公开其确切方,而其他一些公司尚未公开。其他产品很可能与Alnylam公司的 OnpattroTM产品相似(下文将进一步描述),就像已经公开的产品,可能都包含用的可电离脂质。虽然所用的特定可电离脂质可能未知,但其常用种类可以从期刊和**出版物中了解,如表1所示。
表1:目前在进行人体临床测试采用纳米颗粒脂质包裹的mRNA疫苗总结如下。临床试验中的所有mRNA疫苗都使用纳米颗粒脂质体进行递送。其类别和组成尚未公开,因此基于现有文献和**,它们可能的类别如下所示。
在之前,mRNA疫苗用于传染病的临床前和临床研究,包括流感、寨卡病毒、艾zi病毒、埃博拉病毒、狂犬病、基孔肯雅病毒、疟疾、生殖器疱疹、弓形虫等。这些研究被总结在近的一些综述中。
COVID-19
SARS-CoV-2
LNP:脂质纳米颗粒
CNE:阳离子纳米乳剂
NLC纳米结构脂质载体
PBAE:聚β氨基酯
PACE:聚(胺-共-酯)
Epo
hPBAE:超支化聚β-氨基酯
PEI:聚乙烯亚胺
pABOL:二硫化物连接的聚酰胺基胺
SPLP:质粒-脂质颗粒
SNALP:核酸脂质颗粒
IFN:干扰素
HAI:血凝抑制试验
CVnCoV:CureVac mRNA LNP
mAbs:单克隆抗体
VHH:Vh结构域
M2e:基质蛋白2外域
Tfh:滤泡辅助T细胞
本文文献的参考文献格式:
Michael D. B;Manuel J. C;Suman A;Mikell P;Mohamad G A;Drew W. Nanomaterial Delivery Systems for mRNA Vaccines. Vaccines 2021, 9, 65
上一篇 : 2021年AVT原辅料产品注册情况一览
下一篇 : 可电离的阳离子脂质将不带电?